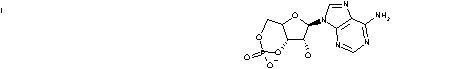Testy-Biochemie I – 6 Enzymy
+ koenzymy - struktura
1. Která látka obsahuje podle vašeho odhadu makroergickou vazbu a proč.

2. Vypočítejte DGo reakce:
sacharosa + Pi Û glukosa-1-P + fruktosa
víte-li že: sacharosa Û glukosa + fruktosa DGo = -29 kJ/mol
glukosa-1-P Û glukosa + Pi DGo = -20 kJ/mol
3. Vypočítejte DGo následující enzymové reakce:
fosfoenolpyruvát + glukosa Û glukosa-1-fosfát + pyruvát
víte-li, že DGo hydrolýzy PEP je -62 kJ/mol, DGo hydrolýzy glukosa-1-P je
-21 kJ/mol.
Vypočítejte rovnovážnou konstantu této reakce při
4. Vypočítejte DG reakce:
uriditrifosfát Û UMP + 2Pi
víte-li, že DGo reakce: UTP Û UMP + difosfát -32 kJ/mol
DGo reakce difosfát Û 2Pi -33,4 kJ/mol
aktuální koncentrace reaktantů:
UTP
5. Vypočítejte DG při
difosfát + ADP Û ATP + Pi,
víte-li že DGo hydrolýzy ATP Û ADP + Pi je -30 kJ/mol.
DGo hydrolýzy difosfát Û 2Pi je -33 kJ/mol
koncentrace reaktantů: difosfát 10 mmol/l, ATP 10 mmol/l, ADP 20 mmol/l, Pi 100 mmol/l.
6. Vypočítejte DGo reakce:
2 ADP Û ATP + AMP,
znáte-li tyto údaje: ADP Û AMP + Pi DGo = -27 kJ/mol
ATP Û ADP + Pi DGo = -30 kJ/mol
Vypočítejte rovnovážnou konstantu reakce
Která z uvedených sloučenin má makroergní vazbu a proč?
7. Vypočítejte DG uvedené reakce:
ATP + Pi Û ADP + PPi
platí-li že DGo hydrolýzy ATP je -30 kJ/mol, DGo hydrolýzy PPi na fosfát je -33 kJ/mol.
Aktuální koncentrace reaktantů: ATP 1 mmol/l, ADP 5 mmol/l, Pi = 0,1 mol/l, PPi = 10 mmol/l.
8. Vypočítejte DGo následující enzymové reakce:
fosfoenolpyruvát + glukosa Û glukosa-1-fosfát + pyruvát
víte-li, že DGo hydrolýzy PEP je -62 kJ/mol, DGo hydrolýzy glukosa-1-P je
-21 kJ/mol.
Vypočítejte rovnovážnou konstantu této reakce při
9. Co je akompetitivní inhibice?
10. K určitému enzymu byl přidán inhibitor a zjištěna úplná inhibice enzymové reakce. Po prolití směsi kolonkou pro gelovou chromatografii inhibiční efekt zmizel.
O jakou inhibici se jedná. Vysvětlete.
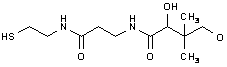
11. Enzym A má tyto kinetické parametry: Km=
Které tvrzení je pravdivé a proč.
a) Enzym A má vyšší afinitu k substrátu a reakce proto probíhá vyšší rychlostí.
b) Enzym A má nižší afinitu k substrátu, ale při vysoké koncentraci substrátu probíhají reakce stejnou rychlostí.
c) Afinita enzymu k subtrátu je při jeho nekonečné koncentraci stejná a vzhledem k identickým katal. konstantám budou při vysoké koncentraci substrátu rychlosti u obou reakcí stejná.
12. NAD je koenzymem dehydrogenas. Reakce katalyzovaná glutamátdehydrogenasou je dvousubstrátová, mechanismus uspořádaný, koenzym se váže jako první. Popište mechanismus reakce (NADH a NH3 berte pro zjednodušení jako jednu látku. Jakým způsobem byste zjistili skutečnou velikost Km pro NAD?:
glutamát + NAD Û oxoglutarát + NADH + NH3
13. Popište závislost rychlosti enzymové reakce na pH. Proč rychlost enzymové reakce závisí na pH.?
14. Popište závislost rychlosti enzymové reakce na teplotě. Jakými zákonitostmi se části křivky řídí? Jak byste vysvětlili, že některé bílkoviny jsou schopny odolávat vysoké teplotě?
15. Jak vysvětlíte, že enzym glukosaoxidasa (obsahující jako prostetickou skupinu FAD) oxiduje pouze D-glukosu a nikoli L-glukosu? Která část enzymu je zodpovědná za specifitu této katalýzy a proč.
16. Michaelisova konstanta
určitého enzymu je Km=
vypočítejte:
a) jakou rychlostí bude reakce probíhat,
b) jaká je limitní rychlost této reakce,
c) jaká je konstanta specifity.
17. Močovina může být hydrolyzována enzymově a neenzymově. Zakreslete závislost rychlosti enzymové reakce na teplotě a srovnejte s neenzymovou.
Jakým vztahem se řídí závislost katalytické konstanty na teplotě v rozsahu nižších teplot?
18. Víte-li že DGo reakce
acetylfosfát + HSKoA Û acetylKoA + Pi je -12 kJ/mol
a DGo hydrolýzy acetylKoA na acetát je – 31 kJ/mol,
vypočítejte DGo hydrolýzy acetylfosfátu na acetát.
Bude-li koncentrace acetátu 0.1 mol/l, jaký bude poměr acetylfosfát/acetát v rovnováze? (
19. Vypočítejte DGo reakce 3b
pyruvát + ATP Û fosfoenolpyruvát + AMP + Pi
víte-li že DGo hydrolýzy PEP je -62 kJ/mol, DGo hydrolýzy obou fosfátů z ATP je stejná a je rovna -30 kJ/mol.
Bude-li koncentrace fosfátu 0.1 mol/l, koncentrace ATP/ADP =
1, jaký bude poměr koncentrací PEP/pyruvát
v rovnováze? (
20. Vypočítejte DG uvedené reakce:
Glukosa-1-P + Pi Û glukosa + PPi
platí-li že DGo hydrolýzy glukosa 1-P je
glukosa-1-P Û glukosa + Pi -20,9 kJ/mol,
DGo hydrolýzy PPi na fosfát
PPi Û 2 PPi je -33 kJ/mol.
Pokud by koncentrace glukosy a glukosa-1-P byly ekvimolární a koncentrace PPi
21. Zakreslete křivku závislosti enzymové reakce na teplotě.
Jakým vztahem je definována rostoucí část křivky? Co jsou to termostabilní
enzymy? Glukosaoxidasa
bakterialni denaturuje při
22. Popište reakční mechanismus acidobazické katalýzy: hydrolýzy peptidové vazby, které funkční skupiny se nacházejí v katalytickém centru proteinas?
23. Zařaďte následující enzymy:
aledehyd + NADH + H+ ® NAD+ + alkohol
glukosa + ATP ® glukosa-6-P + ADP
acetylKoA + ATP + CO2 ® malonylKoA + ADP + Pi
možnosti: oxidoreduktasy, izomerasy, transferasy, lyasy, ligasy, hydrolasy.
24. Reakce typu .
kys. asparagová + pyruvát Û alanin + oxalacetát
je katalyzovaná enzymem aminotransferasou s koenzymem pyridoxalfosfátem a její mechanismus je ping-pongový. Napište postupný reakční mechanismus této reakce zahrnující postupný vznik komplexů ES1 a ES2 a produktů, kde jako substráty dosaďte reaktanty výše uvedené reakce. Napište strukturu produktu reakce mezi pyridoxaminem a kys. pyrohroznovou
25. Reakce je katalyzovaná enzymem E. Zakreslete průběh závislosti počáteční rychlosti reakce na koncentraci substrátu S. Napište rovnici této závislosti a popište jednotlivé symboly. Co je akompetitivní inhibice enzymu? jakou analýzou se tato inhibice prokáže?
26. Alanin se metabolizuje jak je popsáno v případě 8. Koncentrace obou enzymů je stejná:
8 nM, katalytická konstanta transaminasy je 200 s-1, dekarboxylasy 850s-1. Jaká bude limitní rychlost obou reakcí?
Je-li Km pro alanin dekarboxylasy
27. Měřením kinetické závislosti rychlosti oxidace glukosy enzymem glukosaoxidasou byly získány v přítomnosti inhibitoru reakce následující křivky. určete o jaký typ inhibice se jedná a pokuste se vybrat z následujících látek (galaktosa, hydroxylamin, thiomočovina) možný inhibitor, který by tyto křivky vysvětloval. Horní bez inhibitoru, dolní s inhibitorem.
vo

S
28. Popište, co znamená inhibice kompetitivní a nekompetitivní u enzymové reakce. Při měření závislosti rychlosti reakce na koncentraci substrátu byla zjištěna následující závislost (bez přítomnosti a v přítomnosti inhibitoru i). O jaký typ inhibice se jedná? vysvětlete.
0 i S![]()
![]()

![]()
29. Ke 2 enzymům byly přidány ke každému jiný inhibitor a zjištěna úplná inhibice enzymové reakce. Po prolití obou směsí kolonkou pro gelovou chromatografii inhibiční efekt zmizel v prvním případě, zatímco v druhém efekt nezmizel.
O jakou inhibici se jedná. Vysvětlete.
30. Co je číslo přeměny enzymové reakce? Pokud mají 2 enzymy stejné číslo přeměny, napište, bude stejná i rychlost enzymové reakce? Pokud ne, tak na čem to záleží?
31. Co je aktivní místo enzymu, jaká je jeho funkce (teorie aktivního přizpůsobení)
32. Co je číslo přeměny enzymové reakce? Pokud mají 2 enzymy stejné číslo přeměny, napište, bude stejná i rychlost enzymové reakce? Pokud ne, tak na čem to záleží?
33. Měřením kinetické závislosti rychlosti oxidace glukosy enzymem glukosaoxidasou byly získány v přítomnosti inhibitoru reakce následující křivky. určete o jaký typ inhibice se jedná a pokuste se vybrat z následujících látek (galaktosa, hydroxylamin, thiomočovina) možný inhibitor, který by tyto křivky vysvětloval.
34. Oxidace glukosy je dvousubtrátová reakce (koenzym FAD), řídící se mechanismem ping-pong. Popište
glukosa + O2 Û kys.
glukonová + H2O2
35. Co je to akompetitivní inhibice enzymové reakce a jakým typem grafické analýzy tento mechanismus potvrdíte?
36. Reakce je katalyzovaná enzymem E. Zakreslete průběh závislosti počáteční rychlosti reakce na koncentraci substrátu S. Napište rovnici této závislosti a popište jednotlivé symboly. Co je nekompetitivní inhibice enzymu? jakou analýzou se tato inhibice prokáže? 2b
37. Jaký je význam vitaminu biotinu jako kofaktoru transferas, napište strukturu produktu navázané funkční skupiny. Uveďte příklad reakce, kde se biotin uplatňuje.
38. Kofaktory oxidoreduktas jsou železo-sirné proteiny. Co jsou to za látky, jaká je jejich struktura a mechanismus funkce.
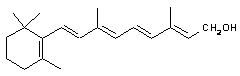
39. Jaký je význam a funkce vitaminu K?
40. Jaká je funkce vitaminu C?
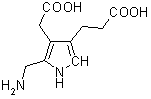
41. Vyjmenujte všechny významné biochemické sloučeniny, obsahující ve své molekule síru, pokuste se nakreslit aspoň část molekuly obsahující síru 2b
42. Kyselina lipoová je koenzymem transferáz. Jako funkční skupinu tato látka přenáší? Napište strukturu kys. lipoové s navázanou přenášenou skupinou.
43. Jaká je funkce vitaminu B12? něco o struktuře, mechanismu působení, avitaminoze atd.
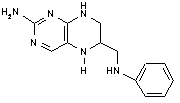
44. Na obrázku je uvedena struktura části vitaminu, kys. folové. Jaký má tento vitamin biologickou roli jakožto koenzym tranferas? Zakreslete, kam a v jaké formě se přenášená skupina váže. 2b

45. Na obrázku je zkreslena struktura FAD, koenzymu oxidoreduktas. Zakreslete, kde probíhá postupná redukce konezymu.

Ve kterém místě a jakým mechanismem probíhá redukce?
46. Napište rovnici redukce NAD+ (aktivní část koenzymu). Co je redoxní agens? Jaký je rozdíl ve struktuře a funkci NAD a NADP?

Ve kterém místě a jakým mechanismem probíhá redukce?
Pojmenujte a charakterizujte (funkce)





 ¨
¨