4. Peptidy a bílkoviny
Reakce aminokyselin – typické reakce karboxylu (esterifikace, amidace) a aminoskupiny (acylace, diazotace)
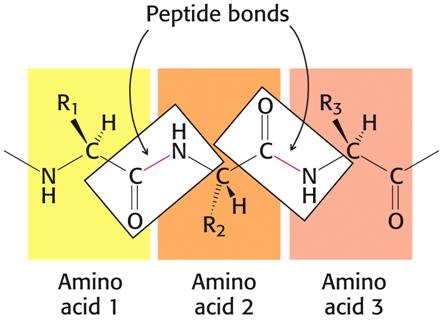
Nejvýznamnější tvorba amidu mezi karboxylem jedné a aminoskupinou druhé aminokyseliny, vzniklá amidickou vazba se nazývá vazbou peptidovou:
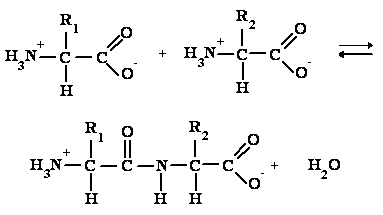
Vzniklý produkt se pak nazývá peptidem a je dále charakterisován podle počtu aminokyselinových zbytků (aminoacylů). V nejjednodušším případě (viz horní rovnici) je tvořen dvěma zbytky a nazývá se dipeptid. Peptidy o 3, 4, 5 atd. aminoacylech jsou tri-, tetra-, pentapeptidy atd., peptidy obsahující přes 10 zbytků se obecně nazývají oligopeptidy, velké peptidy (ca od 100 zbytků) se nazývají bílkovinami (viz dále). Toto dělení však není vždy striktně dodržováno a setkáme se s názvy polypeptid i u větších molekul a naopak bílkovina u menších.
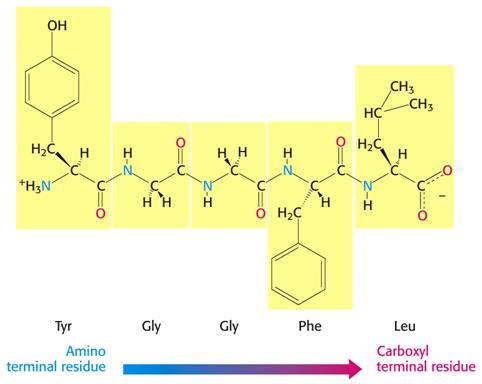 Význam pořadí aminoacylů
Význam pořadí aminoacylů
Přírodní
peptidy
Di - karnosin
anserin
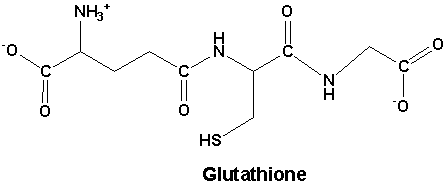
Tri - glutathion GSH
Peptidové hormóny - oxytocin
vasopresin
inzulin
glukagon
Peptidové neuromodulátory - enkefaliny
endorfiny
Peptidová antibiotika - penicilin
gramicidin
valinomicin
aktinomycin
Peptidové fyto a zootoxiny - neurotoxiny hadů štírů a včel
mikrocystiny
falloidin
amanitin


Struktura insulinu
Prostorová struktura peptidů
Tvar řetězce není lineární
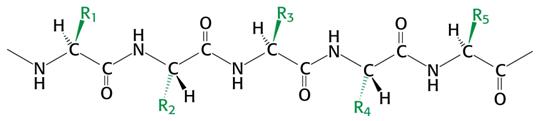
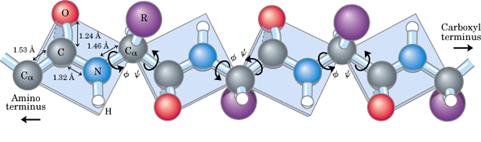
Peptidová vazba má částečně násobný charakter, délka C-N je 133 pm (oproti 145 u jednoduché), C=O zde je delší než normálně (123 pm). Vazba je rigidnější a to má vliv na další skládání řetězce.
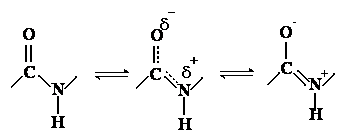
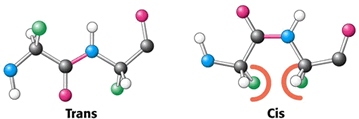
Peptidová vazba je planární, sousedící Cα jsou v trans poloze a roviny vazeb se mohou otáčet podle osy Cα – N a Cα – C. Úhly otočení označujeme Ф a Ψ:
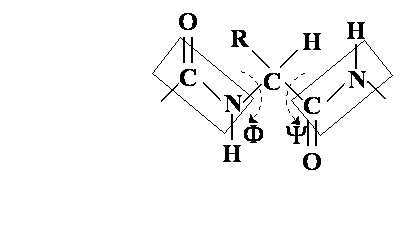
Znázornění vzájemného vztahu rovin dvou
sousedních peptidických vazeb v tripeptidu
Roviny peptidových vazeb otočné kolem
vazeb Cα – NH a Cα
- CO
Hodnoty dihedrálních úhlů jsou omezeny
sterickými poměry v okolí. Animace znázorňuje vztah van der Waalsových poloměrů
kyslíku a vodíku na sousedících -CO a -NH skupinách při otáčení rovin peptidové
vazby.
Dihedrální úhly mohou nabývat
poměrně omezené množiny hodnot. Ty byly určenyeny s použitím hodnot van
der Waalsových poloměrů pro všechny aminokyseliny v tripeptidu a vyneseny
do diagramů nazvaných podle svého tvůrce Ramachandranovými.
Vysoce pravděpodobné hodnoty pokrývají tmavozelené oblasti, nahoře vlevo pak
dihedrální úhly určují tzv. β-strukturu, dole α-šroubovici. Možnými,
ale méně pravděpodobnými hodnotami jsou pak takové, kde pnutí molekuly je ještě
dostatečně malé – světlezelené oblasti. Vpravo nahoře se objevuje málo se
vyskytující struktura levotočivé α-šroubovice. Bílé oblasti označují
oblasti nepřípustných hodnot dihedrálních úhlů.
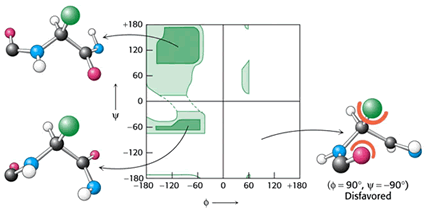
Ramachandranův diagram stability sekundárních struktur bílkovin
Řetězec musí umožňovat maximální počet vodíkových vazeb mezi peptidickými vazbami
Typy
sekundárních struktur
A. Pravidelné - helikální struktury - a helix (-56, -47)
- b struktury - skládaný list - paralelní (-139, +135) a antiparalelní (-119, +113)
B. Ohybové - b ohyb
C. Nepravidelné
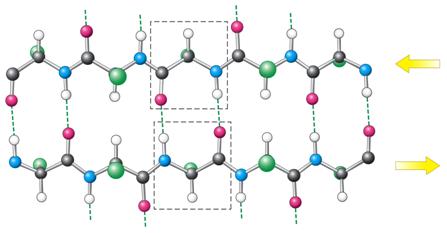
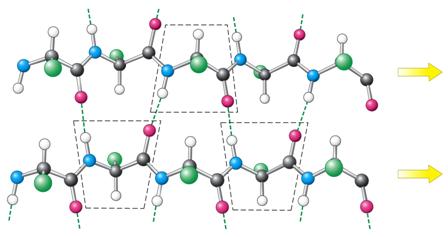
b-skládaný
list – antiparalelní a paralelní
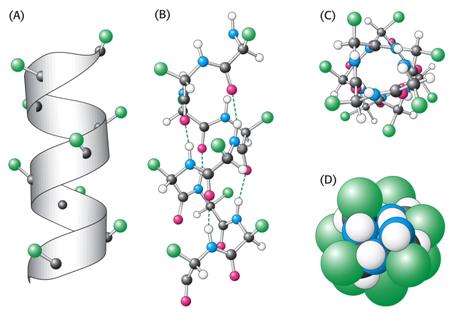
Modely a-šroubovice
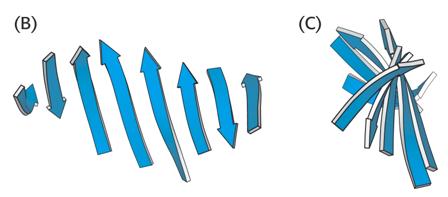
Schematická znázornění struktur skládaného
listu a šroubovice v supersekundární struktuře
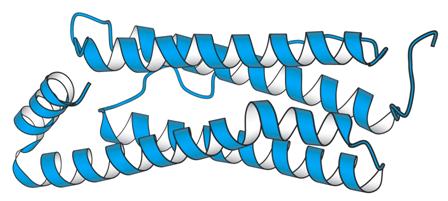
Terciární struktura
1. Iontové interakce
2. Dipolové interakce
3. Vodíkové můstky
4. Hydrofobní interakce
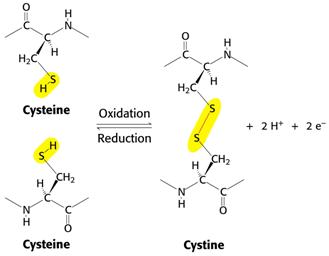
5. Bisulfidické můstky
Strukturní motivy - domény
Kvarterní struktura
Podjednotkové složení - nekovalentní spojení - vodíkové můstky
- kovalentní spojení - bisulfidické můstky
Nebílkovinné součásti bílkovin
Většina bílkovin obsahuje mimo samotný polypeptidický řetězec ještě další komponenty – mluvíme pak o složených bílkovinách (na rozdíl od jednoduchých, které jsou tvořeny pouze polypeptidovým řetězcem). Pevně, většinou kovalentně vázanou nebílkovinnou složku složených bílkovin nazýváme prostetickou skupinou. Podle jejího charakteru pak rozeznáváme několik skupin složených bílkovin:
- glykoproteiny obsahující sacharidovou komponentu. Její výskyt je však poměrně obecným jevem, takže bílkoviny s obsahem do 5% sacharidové složky takto často nenazveme.
- metaloproteiny obsahující kovy. Podle jeho charakteru specifikujeme jako např. feroproteiny, molybdo-, kupro- atd. Bílkoviny často váží kovy volně, pak je jako složené neuvažujeme.
- fosfoproteiny
- lipoproteiny – obrovské agregáty bílkovin s lipidy a dalšími hydrofobními molekulami
Konformace
Skládání řetězce, principiální úloha primární struktury, vliv prostředí, změny konformace.
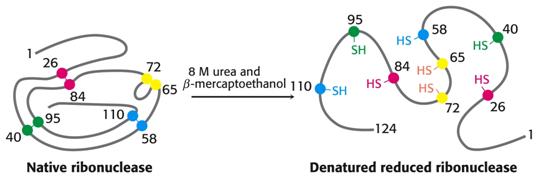
Bílkovina v roztoku, chování, denaturace.
Denaturace - fyzikální faktory - T, záření, tlak,
- chemické faktory - pH, organická rozpouštědla, detergenty, těžké kovy, močovina,
![]() reverzibilní - renaturace
reverzibilní - renaturace
![]() Denaturace
Denaturace
ireverzibilní
Metody studia bílkovin
- Isolace – metody dle smyslu (čisté nativní bílkoviny pro studium vlastností event. farmakologii, hrubé isolace pro průmysl apod.)
- Analýza – elfo, spektrální, RTG, NMR aj.
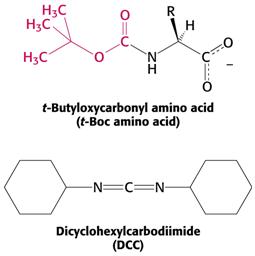
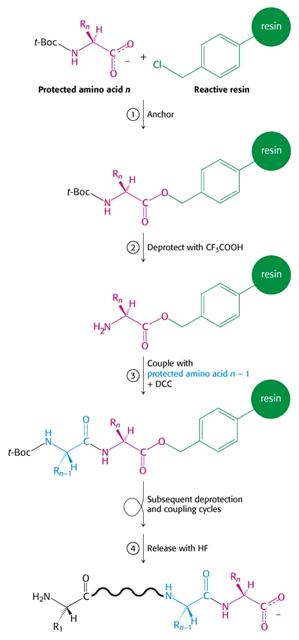
Syntéza polypeptidů
Ačkoli se postupně rozvinula řada efektivních molekulárně biologických metod přípravy bílkovin, z nichž mnohé jsou průmyslově využívány (insulin), příprava chemickou syntézou má stále opodstatnění. Vychází z obvyklých syntetických postupů, kdy reagují aminokyseliny s aktivovanými skupinami, které mají vytvořit peptidovou vazbu, naopak se chrání skupiny, které spolu reagovat nemají. Hlavním problémem bylo čištění meziproduktů, které v roztoku vede ke značným ztrátám a tím znemožní syntézu delších řetězců.
Funkce bílkovin a příklady:
- strukturní
- katalytická
- transportní
- signální
- obranné