6A. Hemoglobin
Struktura hemoglobinu (Hb)
Funkční hemoglobin je tetramer složený ze
- 2 podjednotek α (lehké řetězce, 141 aminokyselin) a
- 2 podjednotek β (těžké řetězce, 146 aminokyselin)
- symbolicky označujeme tento tetramer jako α2 β2
Označuje se HbA (adult) ev. HbA1 chceme-li odlišit od minoritního (2,5%) HbA2 o složení α2 δ2 rovněž se v organismu vyskytujícího
V každé podjednotce je vázán jeden hem jako prostetická skupina koordinační vazbou Fe2+ na zbytky His (přímo na proximální His 93, zprostředkovaně na distální His 64)
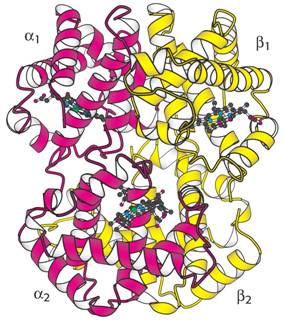
Model hemoglobinu, v řetězcích se
dále rozlišují oblasti (ramena) A – H

Struktura hemo, Fe je
fysiologicky jako Fe2+, oxidace na Fe3+ je nefysiologická
(místo hemu jde o hemin, místo hemoglobinu máme methemoglobin)
Funkce hemoglobinu
Fe2+ je vázán 4 vazbami na porfyrinový kruh, 5. koordinační místo je obsazeno proximálním His 93. Fysiologickým ligandem 6. koordinační místa je O2, vázat se mohou i jiné ligandy, velmi pevně se váže CO (otrava svítiplynem, spalinami nedokonalého hoření apod.)
Vazba je vratná a lze ji popsat rovnicemi
Hb + O2 = Hb.O2 ev. Hb + CO = Hb.CO
Hb nazýváme dexoyHb,
Hb.O2 – oxyHb, Hb.CO – karbonylHb

Formy a struktury Hb s různými ligandy. Povšimněte si vlivu obsazení 6. koordinačního místa ligandem, kdy se Fe2+ přemisťuje do roviny porfyrinového kruhu. Vedle změn elektronové struktury vidíme rovnici reakce mezi Hb, O2 a CO, hodnota K nás přesvědčí, že CO je mnohem pevněji vázán než kyslík. Přesto lze otravě zabránit eliminací CO a zvýšeným přívodem kyslíku.
Fysiologickou funkcí Hb je ovšem přenos kyslíku v krvi (z plic ev. žaber do tkání).
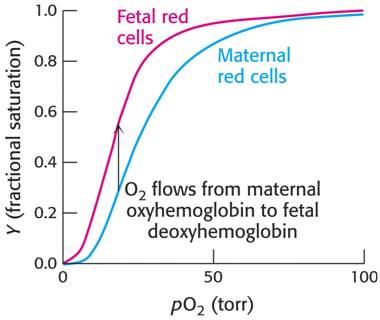
Stupeň nasycení Hb kyslíkem (tj. HbO2/(HbO2 + Hb)) závisí na jeho parciálním tlaku pO2 v okolním prostředí. Průběh této závislosti vidíme na dalším obrázku – červená křivka.

Závislost stupně nasycení Hb kyslíkem (Y) na pO2 – torr = 133 Pa.
Hb se sytí kyslíkem v plicích, uvolňuje ho v tkáních. Proces je zefektivněn kooperativitou (vzájemným ovlivněním) vazných míst pro kyslík (4 hemy v celém tetrameru). U Hb to znamená, že po navázání první molekuly kyslíku na jeden hem dochází ke konformační změně způsobující zvýšení afinity zbylých vazných míst pro kyslík – viz červená křivka. Pokud k tomuto efektu nedochází (například u myoglobinu, který je monomerem), je přenos kyslíku méně efektivní – viz modrá křivka.
Zíkladem pro toto chování je změna struktury vyvolaná vazbou kyslíku na Fe2+ jedné z podjednotek – viz též nahoře):
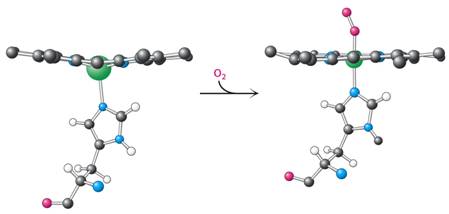
Fe2+ za sebou táhne His
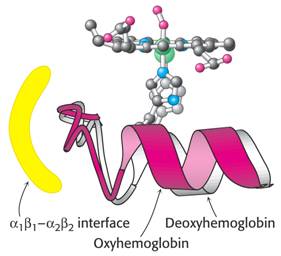
Schematické znázornění konformační změny vlivem vazby kyslíku na hem. Změna se přenese na ostatní podjednotky. Molekula Hb přechází z tesnější konformace T (tense) s nízkou afinitou ke kyslíku do uvolněné konformace R (relaxed) s vyšší afinitou. Toto chování je jedním z typů allosterie.
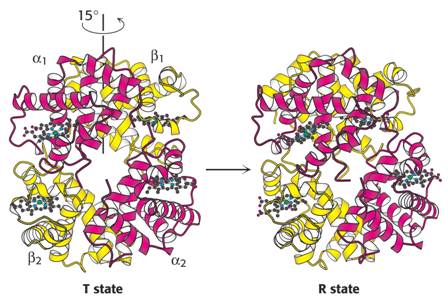
Modely konformačních stavů T a R
Zvýšení efektivity přenosu kyslíku je dosaženo též vlivem některých metabolitů, které působí na allosterické chování Hb jako tzv. allosterické efektory. Mimo CO2 a H+ takto působí i meziprodukt glykolýzy 2,3-bisfosfoglycerát
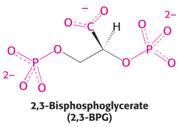
Tento metabolit stabilisuje deoxy-Hb interakcí svých kyselých skupin s His 143 β-řetězců:
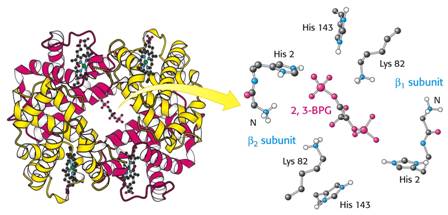
Tak si lze představit snazší uvolňování kyslíku při intensivnější glykolýze.
Vliv pH na vazbu kyslíku na Hb.
Hb a HbO2 se liší acidobasickými vlastnostmi, Hb je slabší kyselinou než HbO2. Toto positivně ovlivňuje efektivitu přenosu kyslíku.
Produkce CO2 ev. laktátu v tkáních (pracující sval) zde zvyšuje [H+]. Poněvadž HbO2 je silnější kyselinou, je zde posílena jeho deoxygenace (tvoří se basičtější Hb). Naopak v plicích dochází při ventilaci CO2 ke zvýšení pH a upřednostní se oxygenace (tvorba kyselejšího HbO2).
Toto chování Hb se nazývá Bohrovým efektem (popsal dánský fysiolog Carsten Bohr, otec Nielse Bohra). Předpokládá se podobný mechanismus u translokace protonů přes membránu pomocí oxidačně-redukčních změn komplexů dýchacího řetězce nebo fotosyntetických reakčních center.

Vliv pH a CO2 na saturaci Hb. Kromě vlivu samotného rozdílu pH je patrný také specifičtější vliv CO2. množství využitelného kyslíku se zvýší o ca 11%.
CO2 produkovaný při katabolických procesech ve tkáních (sval) je částečně transportován jako HCO3- v krvi, částečně se váže na terminální –NH2 za vzniku karbamátu. První forma přispívá ke zvýšení účinnosti transportu kyslíku cestou Bohrova efektu, ve druhém případě se uplatní jako allosterický efektor – viz obr. nahoře.
Fetální Hb
HbA je efektivní přenašeč kyslíku v organismu přijímajícím kyslík plicemi. Zárodek placentárních savců je zásobován kyslíkem přes placentu matky, kde je nižší pO2 a pro jeho efektivní využití potřebuje Hb schopný ho dostatečně vázat. Proto syntetisuje fetální Hb – HbF, tetramer o složení α2γ2.
Patologické hemoglobiny
HbS
6Glu-Val v β-řetězci
Srovnání saturace HbF a HbA. Vyšší afinita HbF pro kyslík umožňuje jeho přečerpávání z placentární krve do krve plodu.
Po porodu, kdy novorozenec začne dýchat plicemi, se zastaví syntéza polypeptidového řetězce γ a začne se syntetisovat β-řetězec (je to též příkladem regulace proteosyntézy!) HbF (fetal) je degradován (novorozenecká žloutenka při intensivním odbourávání hemu) a nahrazován HbA (adult – „dospělý“).
Patologické hemoglobiny
Mutací – záměnou aminokyselin v jednotlivých řetězcích Hb dochází ke změně jejich vlastností a výskytu odlišných typů Hb – patologických, neboť jejich vlastnosti jim neumožňují fungovat potřebným způsobem.
Zde bude popsán pouze HbS, nazvaný tak podle projevu této poruchy – srpkovité anémie. Tato mutace spočívá v záměně 6Glu-Val v β-řetězci:

Morfologickým projevem této mutace je změněný tvar erytrocytů, které nabývají srpkovitého tvaru (sickle cells – odtud HbS). Fysiologický projev spočívá v nedokonalém transportu kyslíku v krvi – odtud srpkovitá anémie.

srpkovitý
erytrocyt – sickle cell normální erytrocyt
Základem morfologických změn je nová vlastnost HbS. Díky přítomnosti nepolárního zbytku Val 6 vytváří místo tetrameru řetízkové aglomeráty připomínající strukturu aktinu – významné součásti cytoskeletu:
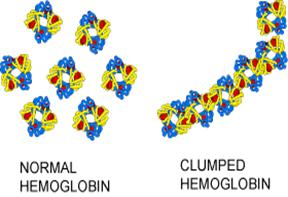
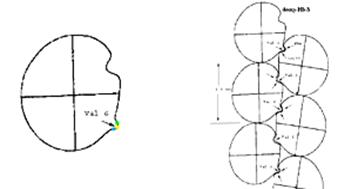
Vliv záměny 6Glu-Val na kvarterní
strukturu HbS ve srovnání s HbA.
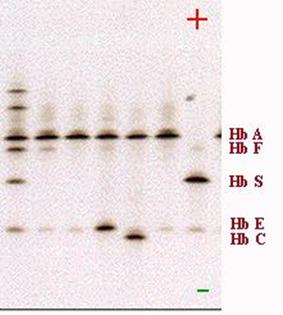
Elektroforetické rozlišení jednotlivých forem Hb. HbS má o 2 Glu- méně, HbF má místo 2 His+ 2 Ser.
Nedokonalá funkce HbS znevýhodňuje nositele vadného genu (allely). Pro homozygoty (obě allely vadné) je to fatální, heterozygoti (mají 1 allelu dobrou) dlouhodobě přežívají s příznaky anémie. Přetrvávání vadné allely bylo předmětem zkoumání, zda nepřináší svému nositeli nějakou výhodu, pro kterou se stále udržuje v populaci.
Srovnávací studie přinesly zjištění, že výskyt vadné allely dobře koreluje s výskytem malárie – viz obrázek dole:
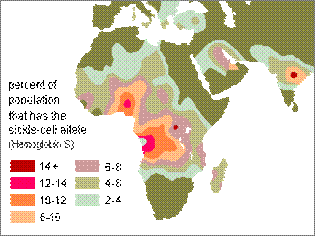

Další studie prokázaly, že nositelé tohoto genu vykazují větší odolnost vůči parazitu.
Pravděpodobným
vysvětlením může být, že k tvorbě řetízků HbS a deformaci erytrocytů
dochází především v kyselém prostředí. Plasmodii infikované erytrocyty
vykazují vyšší produkci laktátu glykolýzou a tak jsou častěji deformovány,
následně rozpoznány jako vadné a zlikvidovány.