14. Kinetika enzymových reakcí
Vliv vnějších podmínek na rychlost enzymové reakce

Vliv pH na rychlost enzymové reakce

Vliv teploty
na rychlost enzymové reakce
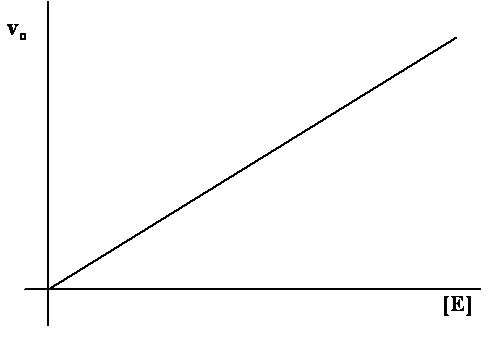
Vliv
koncentrace enzymu na rychlost katalyzované reakce
Kinetika enzymových reakcí
Časový průběh
enzymové reakce – prestacionární a stacionární stav.
Rychlost enzymové reakce závisí na koncentraci
substrátu. Za stacionárních podmínek je tato závislost popsána vztahem
Vlim
. [S]
![]() V0
=
V0
=
KM + [S]
nazývaným rovnicí Michaelise-Mentenové.
Grafickým vyjádřením této rovnice je hyperbola
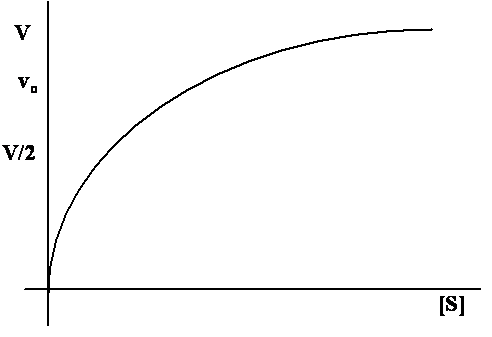
Grafické
znázornění rovnice Michaelise-Mentenové
Pro určení kinetických parametrů je třeba rovnici rektifikovat –
převést na lineární závislost. Nejběžnějším způsobem je dvojnásobné reciproké
vynesení dle Lineweavera a Burka, kdy dostaneme tvar
KM + [S] KM 1 1
![]()
![]()
![]()
![]() 1/v0
= =
. +
1/v0
= =
. +
Vlim . [S] Vlim [S] Vlim
jenž je rovnicí přímky. Její stylizovaný tvar vidíme na vynesení dole:
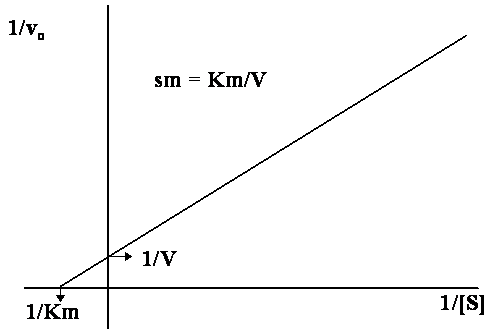
Typické
vynesení dle Lineweavera a Burka
Z jiných způsobů vynesení uvádíme ješte Hanesovo – [S]/v vs. [S]. Modelová závislost
je uvedena níže:
![]()
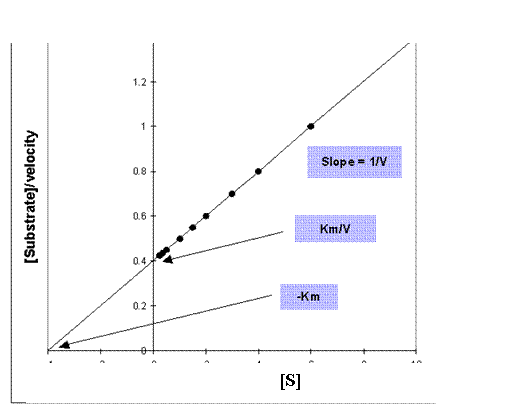
Typické
vynesení dle Hanese
Význam nalezených
konstant
Km je mírou afinity enzymu a substrátu (formálně disociační konstantou komplexu ES), není závislá na katalytickém množství (aktivitě enzymu) v pokusu, pokud pracujeme v oblasti lineární závislosti v na [E] – viz výše. Lze ji tabelovat a užít jako srovnávací parametr. Liší se pro různé substráty téhož enzymu.
Vlim je ukazatelem aktivity enzymu, závisí na katalytickém množství enzymu v experimentu. Dá se užít k vyjádření katalytické účinnosti a čistoty enzymu. V těchto případech se vypočítá tzv. specifická aktivita jako poměr Vlim a množství enzymu (typicky v mg bílkoviny neznáme-li jeho Mr nebo pracujeme se směsí – homogenát, krevní sérum apod.) Známe-li látkové množství enzymu, pak specifickou aktivitu vztaženou na látkové množství enzymu nazýváme číslem přeměny (TN):
Vlim / E ( mol.s-1 / mol) = TN (s-1) = kcat
TN pak značí počet molů (molekul) substrátu přeměněné 1 molem (molekulou) enzymu za 1 s a jde o tzv. katalytickou konstantu (celkovou rychlostní konstantu katalysované reakce) – objektivní vyjádření účinnosti enzymu.

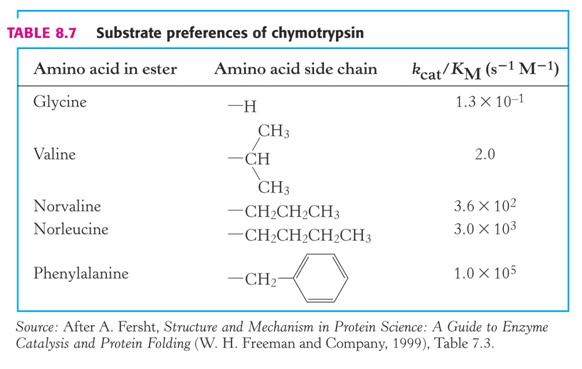
Jako spolehlivější ukazatel substrátové specificity – preference substrátů – se ukázal poměr kcat (čím vyšší, tím účinnější katalýza) a Km (čím nižší, tím větší afinita enzymu k substrátu).
Ovlivnění rychlosti enzymové reakce
V organismech i laboratorních podmínkách lze ovlivnit rychlost enzymové reakce působením chemických látek – efektorů či modulátorů (positivních a negativních), běžně zvaných aktivátory (zvyšují) a inhibitory (snižují rychlost) enzymů. Mají regulační poslání, v laboratoři slouží ke studiu mechanismu působení enzymů. V tomto směru je nejčastější použití inhibitorů.
K tomu slouží především reversibilní inhibitory, jež interagují s enzymem vratně, dají se odstranit např dialýzou, gelovou chromatigrafií apod. Inhibitory ireversibilní se vážou pevně a nevratně.
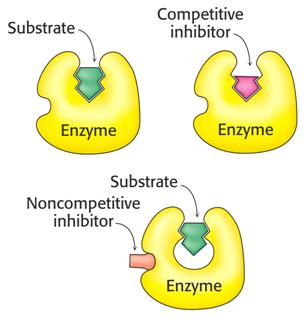
Reversibilní inhibice se dělí na několik typů, z nichž nejvýznamnější je kompetitivní a nekompetitivní,
Kompetitivní inhibice
X
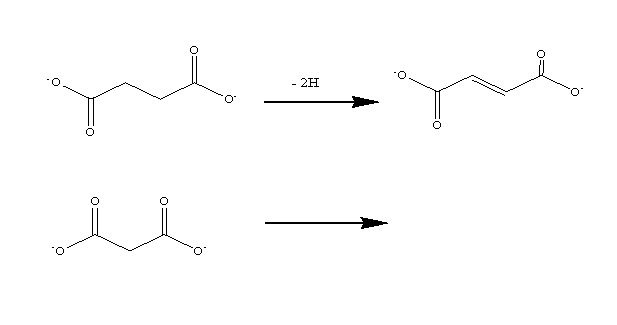
Jantaran (sukcinát) je substrátem enzymu sukcinátdehydrogenasy, vzniká fumarát. Malonát je kompetitivním inhibitorem tohoto enzymu, nelze ho dehydrogenovat. Nutno odlišit od konkurence několika substrátů, které mohou podlehnout enzymové reakci (např. zde deriváty jantaranu).
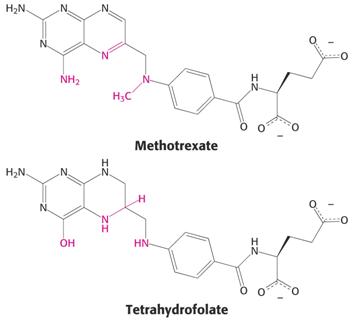
Podobný strukturní vztah bývá základem inhibičního působení tzv. antimetabolitů, např. methotrexátu a THF (dole), podobně sulfonamidy působí kompeticí s p-aminobenzoátem.
Kompetitivní inhibitor reaguje s volným enzymem a soutěží se substrátem o vazné místo v aktivním centru. Může se navázat pouze na volný enzym. V reakční směsi pak máme kromě E, S a ES ještě formu EI (komplex enzym-inhibitor), který se tvoří vratně mezi volným enzymem a inhibitorem:
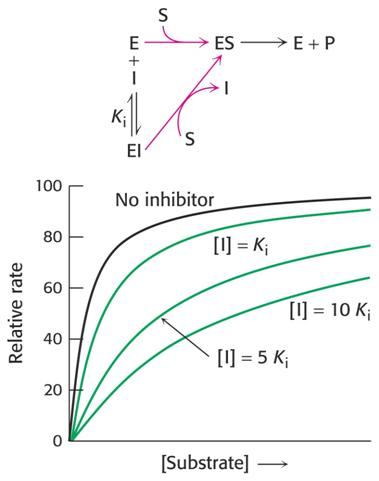
Schema reakcí v přítomnosti kompetitvního inhibitoru a jeho vliv na kinetiku enzymové reakce
Zavedeme-li do vztahu Michaelise a Mentenové faktor
Ki = [E] .
[I] / [EI] a [E]t = [E] + [EI] + [ES]
dostaneme vztah
v = Vlim . [S] / [Km (1+ [I]/Ki) + [S]], kde Km (1+ [I]/Ki) = Kapp
a po rektifikaci
1/v = 1/ Vlim + Kapp/Vlim . 1/[S]
Výraz Kapp nazýváme zdánlivou Michaelisovou konstantou, je vyšší než skutečná přímo úměrně koncentraci inhibitoru a nepřímo Ki.
Grafické vzjádření této závislosti vidíme na vynesení dle Lineweavera a Burka
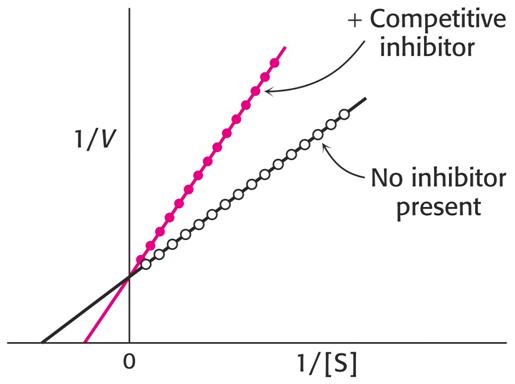
Vidíme, že Vlim se nemění, hodnota Km je zvýšena na hodnotu Kapp.
Analogicky se mění i grafy užívané v jiných vyneseních, např. dle Hanese (směrnice = 1/Vlim je stejná, průsečíky se vzdalují od 0).
Nekompetitivní inhibice
Inhibitor není podobný substrátu, váže se jak na volný enzym tak komplex ES. Vytváří komplex EI, jehož koncentrace nezávisí na koncentraci substrátu, ale pouze inhibitoru.
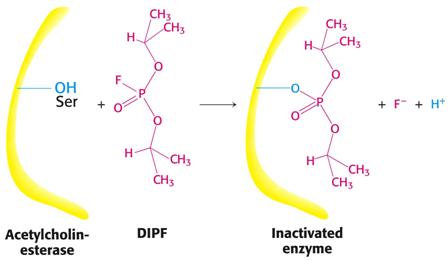
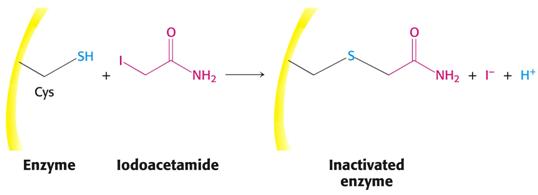
Příklad nekompetitivních inhibitorů serinových hydroláz a sulfhydrylových enzymů.
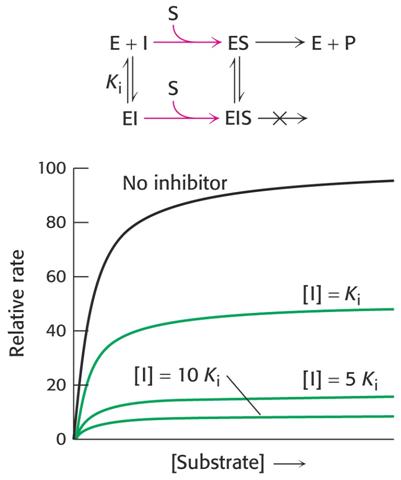
Schema rovnováh v reakční směsi v přítomnosti nekompetitivního inhibitoru a jeho ovlivnění enzymové kinetiky vyjádřeno graficky.
V reakční směsi pak vzniká komplex EI podle rovnice
Et + I = EI
Zavedením do základní rovnice Michaelise a Mentenové pak dostáváme
v
= Vlim
(1+ [I]/Ki) . [S] / [Km
+ [S]]
a po rektifikaci
1/v = (1/ Vlim + Km/Vlim . 1/[S]) . 1/(1+ [I]/Ki)
Grafické vyjádření této závislosti je na obrázku dole. Vidíme, že hodnota Km se nemění, zvýší se průsečík 1/Vlim.
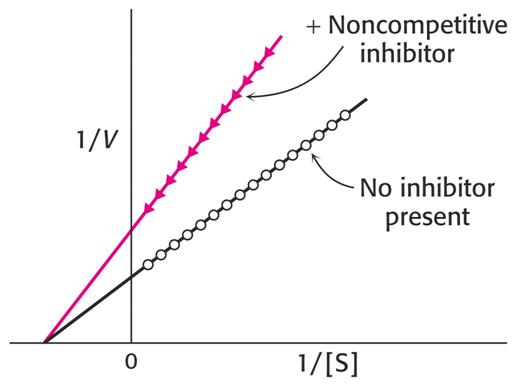
Analogické změny najdeme v jiných vyneseních, u vynesení podle Hanese se zvýší směrnice při zachování průsečíku s osou [S].