24. Biologické oxidace
Oxidace jako přenos elektronů – donor : akceptor
Směr přenosu – záležitost E (formálně E0)
ΔG0 = - nF.Δ E0 ΔG = - nF.ΔE
E = E0’ + RT/nF . ln (aox/ared)
pojem E’ pro nestandartní podmínky
Význam oxidoredukčních pochodů v biochemii
- přeměna substrátů (často oxygenace, hydroxylace, syntézy)
- energetický význam – uvolňování resp. ukládání metabolicky využitelné energie
Enzymy skupiny oxidoreduktas – EC 1…
Názvosloví – donor:akceptor oxidoreduktasa
Triviální
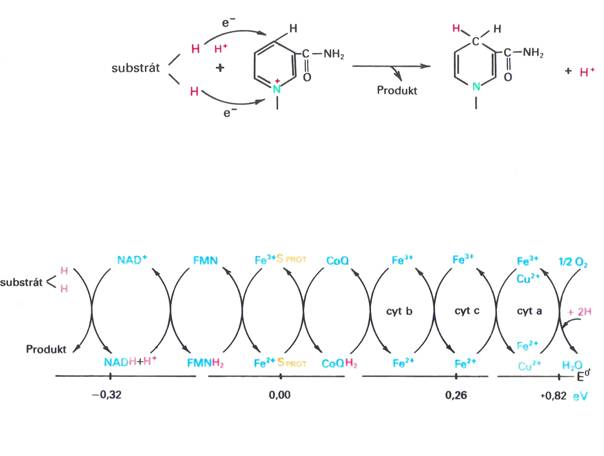
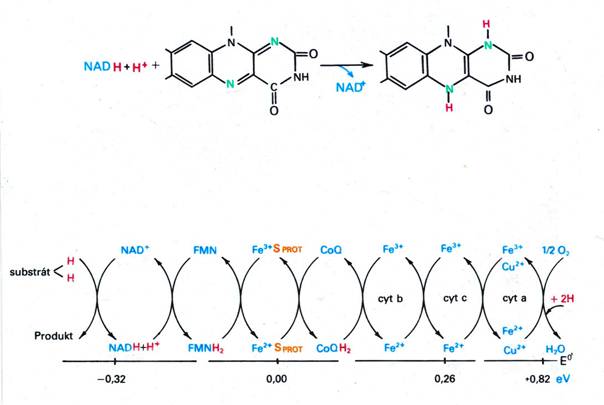
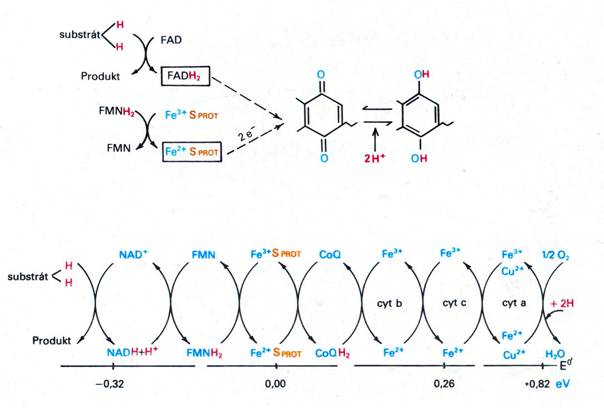
- dehydrogenasy odebírají elektrony ze substrátu
- oxidasy předávají elektrony na kyslík (finální akceptor) – tvoří H2O
- reduktasy (jiný akceptor)
- aerobní dehydrogenasy (přenos elektronů ze substrátu na kyslík) – tvoří H2O2
- peroxidasy
- oxygenasy (mono- a di-)
Pochody zajišťující transformaci a využívání energie
Jednoduchý pochod – jednostupňová oxidace – energie jako teplo
Složité systémy enzymů jako přenašečů elektronů – konverse energie na metabolicky využitelnou formu (typicky ATP, ale i jiné)
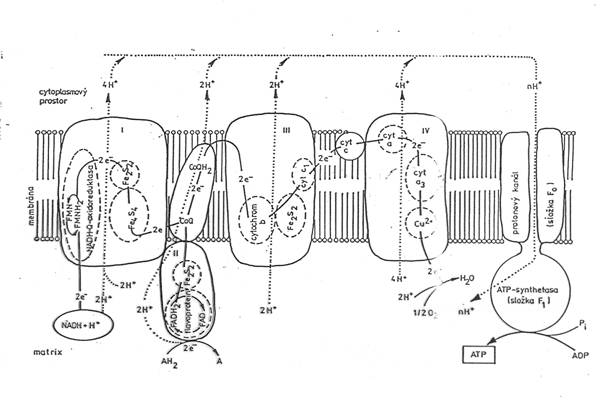
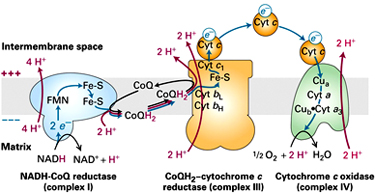
Dýchací řetězec – oxidace substrátů – přenos elektronů na finální akceptor (též řetězec přenosu elektronů)
Uspořádání přenašečů – sekvence dle E0’
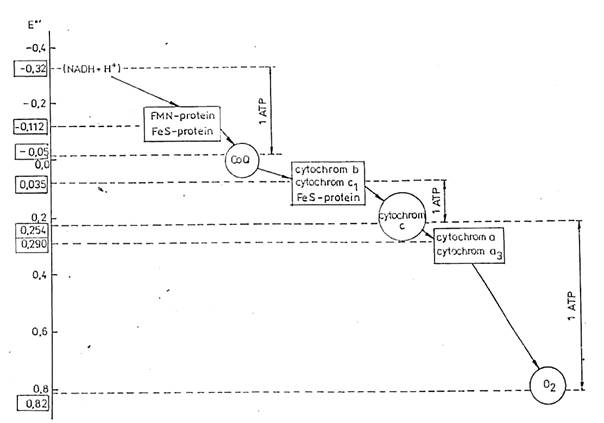
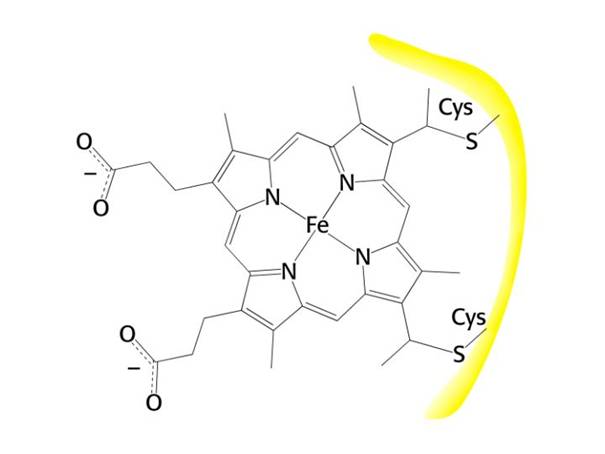
Organisace – komplexy v membráně (vnitřní mitochondriální, cytoplasmatická u prokaryont)
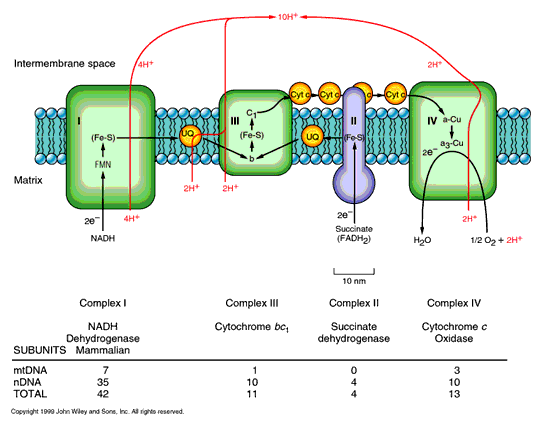
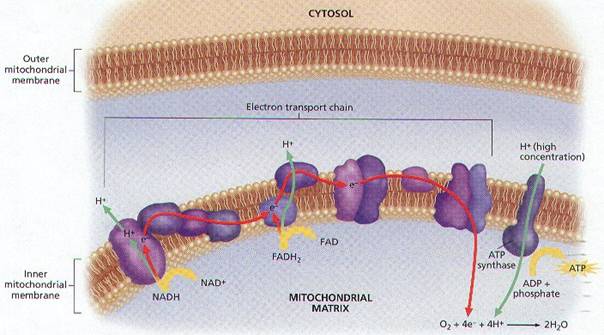
Konverse energie – spřažení oxidace a fosforylace ADP - tvorba ATP oxidační fosforylací
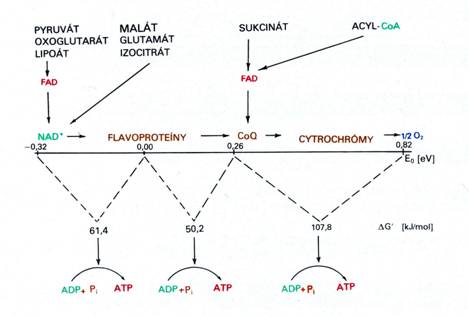
P/O kvocienty – experimentální průkaz
Teorie makroergického intermediátu
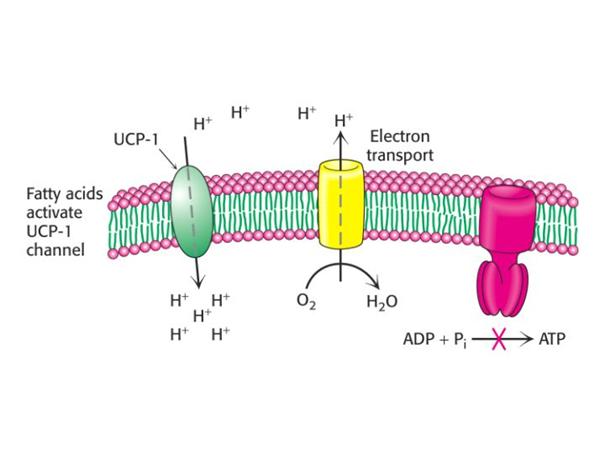
Chemiosmotická teorie – P. Mitchell (1961, Nc 1978)
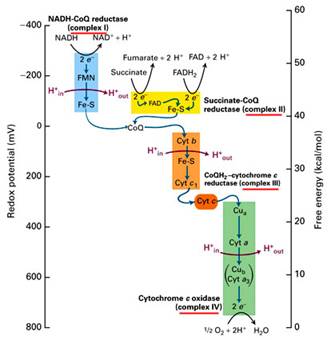
Gradient protonů jako forma energie
Protonmotivní síla – kvantitativní vyjádření této potenciální energie
Chemický potenciál gradientu látky DG = RT . ln (ci/co)
H+ DG = RT . ln ([H+]i/([H+]o) = - 2,3RT . (pHi-pHo) = 59mV . DpH
Elektrická energie přenosu iontu DG = nF.DY, u H+ n=1
Celkově DG
= nF.DY
- 2,3RT . DpH
Dp = DG/F Dp = DY - 0,059mV . DpH
DY
= 0,17 DpH = 0,5 Dp = 0,20 V (85% + 15%)
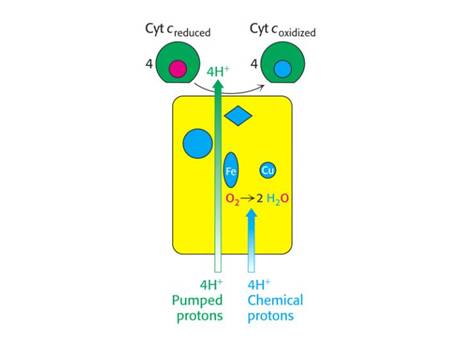
Mechanismus vzniku –
„chemické a pumpované protony“
Využití
- osmotická práce (sekundární membránový transport)
- tvorba ATP
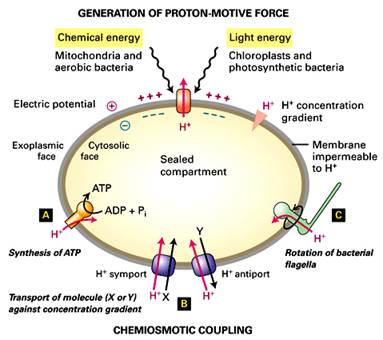
Komplex V – FoF1-ATPasa
Mechanismus – P.Boyer, J. Walker – Nc 1997
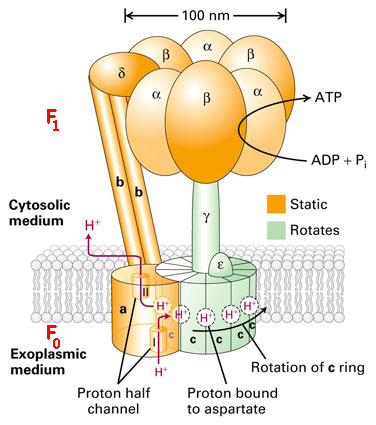
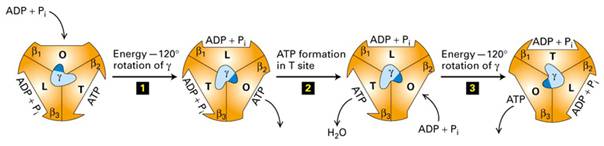
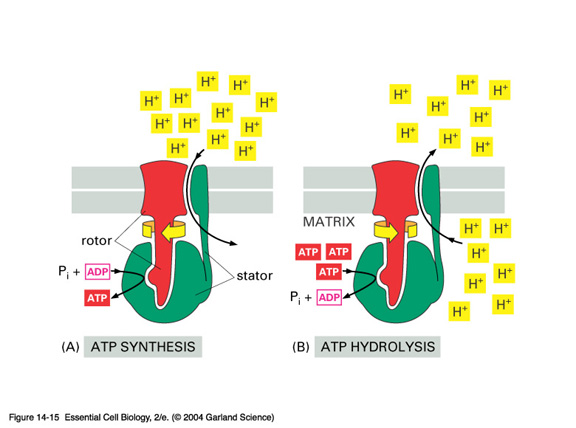
Vztah k cytoplasmě
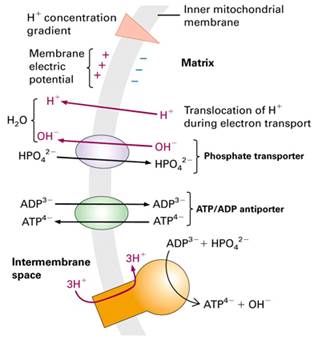
Respirační kontrola – regulace spotřeby substrátu
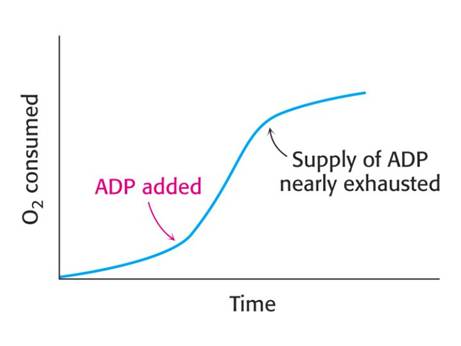
Umělé donory a akceptory elektronů
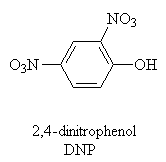
Inhibitory
- inhibitory transportu elektronů
- rozpojovače
- inhibitory H+-ATPasy

Alternativní respirace – finální akceptory jiné než kyslík (nitrátová, sulfátová aj.)
Anorganické donory elektronů (kovy, amoniak, síra)
Metanogeny
ROS