Elektroforéza
v přítomnosti SDS – SDS PAGE
Elektroforéza v přítomnosti SDS – SDS PAGE je jednoduchá, rychlá a reprodukovatelná metoda pro kvalifikovanou charakterizaci a srovnání bílkovin.Tato metoda separuje bílkoviny na základě rozdílné relativní molekulové hmotnosti. SDS se zde váže na bílkovinný řetězec v poměru 1.4 g SDS na 1g bílkoviny, přičemž délka komplexu SDS – bílkovina je úměrná jeho molekulové hmotnosti. Na základě srovnání relativních mobilit neznámé bílkoviny a standardů je pak možné určit její relativní molekulovou hmotnost.
elektromigrační dráha neznámé bílkoviny
Relativní mobilita (Rf
) =
----------------------------------------------------
celková délka
elektroforézy
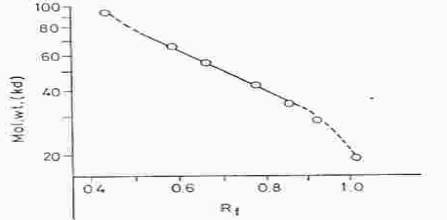
Kalibrační závislost Log MW = f (Rf )
I.
Příprava gelu
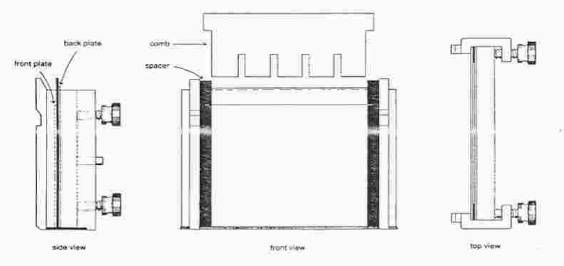
A. Sestavení gelového sendviče
Na stojánek položte držák, k jeho vnitřní straně umístěte delší sklo, na ně spacery a pak kratší sklo. Držák stáhněte a upněte ve stojánku.
B. Nalévání separačního gelu.
Na elektromagnetickou míchačku dejte kádinku s míchadlem a do ní pipetujte roztoky podle schématu, roztoky nepipetujte ústy !
1.3 ml separačniho pufru pH
8.3
1.3 ml
roztoku akrylamidu
2.5 ml
destilované vody
50 μl 10 %
persíranu amonného
5 ul TEMEDu
Promíchejte polymerizační směs zvýšením otáček a nasajte ji do injekční stříkačky. Směs opatrně nastříkněte mezi skla do výše zářezu a převrstvěte n-butanolem. Ponechte polymerovat tak dlouho, až se mezi gelem a vodnou fází vytvoří ostré rozhraní.
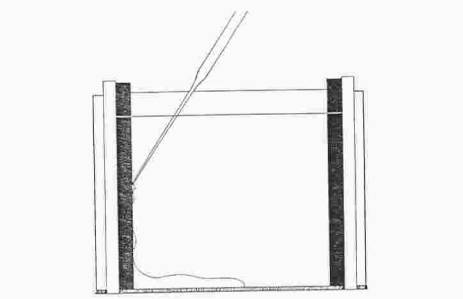
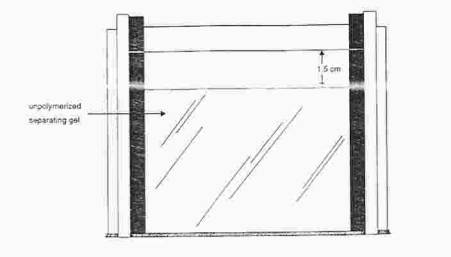
Slijte nezpolymerovanou část, promyjte vodou ze střičky a odsajte přebytek
kapaliny filtračním papírem.
C. Nalévání koncentračního gelu
Na elektromagnetickou míchačku dejte kádinku
s míchadlem a do ní pipetujte
roztoky podle schématu, roztoky nepipetujte ústy !
1.2 ml koncentračního pufru pH
0.7 ml roztoku
akrylamidu
3.1
ml destilované
vody
50 ul 10 % persíranu amonného
5 ul TEMEDu
Promíchejte polymerizační
směs zvýšením otáček a nasajte ji do
injekční stříkačky. Mezi skla nastříkněte polymerizační směs a
vložte do ní hřebínek. Ponechte polymerovat.
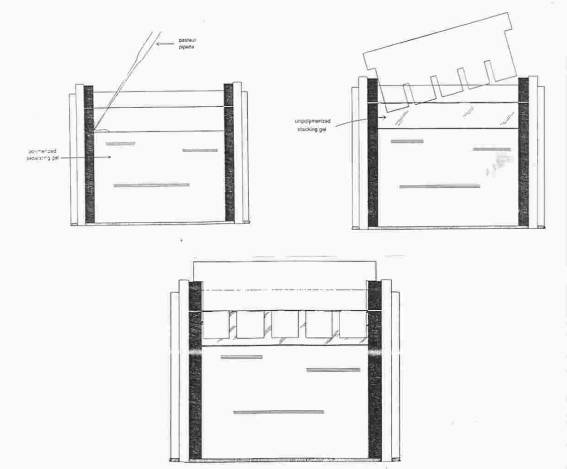
Vyjměte hřebínek
z gelu a vzorkové jamky vypláchněte destilovanou vodou. Gel vložte do vlhké komůrky.
II . Elektroforéza
A. Sestavení aparatury
Ke vnitřnímu elektrodovému prostoru připevněte gel a prázdný držák s kratším sklem. Takto sestavený vnitřní elektrodový prostor vložte do nádobky a naplňte elektrodovým pufrem.
Elektroforetická aparatura Mini Protean II

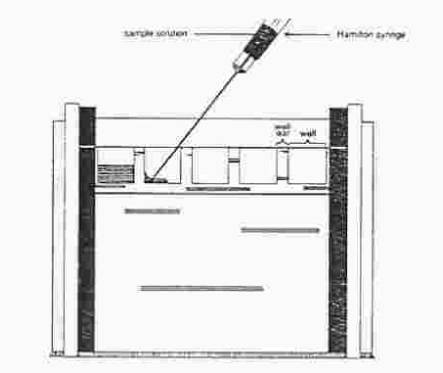
B. Nanesení vzorku.
Do vzorkových jamek naneste pomocí stříkačky
20 ml vzorku,
tak abyste je podvrstvili pod
elektrodový pufr. Mezi
jednotlivými vzorky stříkačku vypláchněte destilovanou vodou.
C. Vlastní elektroforéza
Elektroforetickou aparaturu uzavřete víkem a
připojte ji ke zdroji stejnosměrného napětí. Na zdroji nastavte konstantní
napětí 125 V a po zapnutí ponechte elektroforézu probíhat tak dlouho, až
zóna bromfenolové modři doputuje ke spodnímu okraji gelu.
D. Ukončení elektroforézy
Vypněte zdroj, otevřete elektroforetickou aparaturu, vyjměte z ní vnitřní elektrodový prostor, a slijte elektrodový pufr. Uvolněte z vnitřního elektrodového prostoru držák s gelem a opatrným zapáčením od sebe uvolněte skla. Z gelu odstraňte koncentrační část a zbytek přeneste do fixačního roztoku.
III. Detekce bílkovin stříbrem
krok
roztoky čas
1. 60 ml
50 % acetonu, 1.5 ml
50 % TCA , 25 ml 37 % HCHO 5
min
2. opláchněte 3x deionizovanou vodou 3 x 5 s
3. promytí deionizovanou vodou
5 min
4. opláchněte 3x
deionizovanou vodou 3 x 5 s
5. 60
ml 50 % acetonu
5 min
6. 100 ml 10
% Na2S2O3
v 60 ml deionizované vody 1 min
7 . opláchněte 3x deionizovanou vodou
3 x 5 s
8 . 0.8 ml 20
% AgNO3 , 0.6 ml
37 % HCHO , 60 ml H2O 8 min
9 . opláchněte 2x deionizovanou vodou 2
x 5 s
10. 60
ml 2 % Na2CO3
, 25 ml 37 %
HCHO , 25
ml 10 % Na2 S2O3 10-20 s
11. 1 % HAc 30 s
12. promytí
deionizovanou vodou 10 s
IV. Sušení gelu
Gel přeneste do
1 % roztoku glycerínu a
ponechte jej zde
15 minut ekvilibrovat. Do stejného roztoku
vložte na 5 minut celofánovou folii, gel a zalijte jej trochou
glycerínového roztoku. Gel překryjte
celofánovou folií a pomocí skleněné
tyčinky vytlačte gel gumovou
membránou a vrchním víkem. Zapněte sušičku a ponechte gel sušit asi 2
hodiny při 80 0
C.
!!!!!
Důležité upozornění !!!!!
Monomery
používané pro přípravu gelu jsou neurotoxiny a proto :
·
roztoky nikdy nepipetujte ústy
·
pracujte v rukavicích
·
pracujte v digestoři